来源:开云网站 发布时间:2025-04-28 14:17:38
中国网/中国发展门户网讯生物医药产业是全球竞争性产业,各国发展的基础、时间、体制机制不同,取得的成效不同,也面临不同的难题。“尽量多的盲人一起摸才能更客观地还原大象原本的样子”。各国通过自身实践,累积的成功经验和失败教训,对我国政策制定者把握核心问题、制定有关政策,进而推动生物医药产业高水平质量的发展,具备极其重大的参考价值。
英国研究:1928年,亚历山大·弗莱明(Alexander Fleming)在英国圣玛丽医院疫苗研究实验室偶然发现青霉素,并于1929年在《英国实验病理学期刊》(The British Journal of Experimental Pathology)上发表了相关发现,简略谈及了青霉素的潜在治疗效果。在此阶段,青霉素的线年,英国牛津大学的霍华德·弗洛里(Howard Florey)、恩斯特·钱恩(Ernst Chain)和诺曼·希特利(Norman Heatley)团队研究溶菌酶时,注意到弗莱明的这篇论文,并得到一份他留下的青霉素样品,从而进行了青霉素的提纯和进一步研究工作。1940年,弗洛里团队在《柳叶刀》(The Lancet)发表文章,描述了青霉素在小鼠实验中对葡萄球菌、链球菌和梭菌等病原体引起的感染的疗效。纯化青霉素后,钱恩主张申请专利,而弗洛里倾向于放弃专利,造福世界。英国医学研究委员会(MRC)因资金缺乏等原因,也反对申请专利。
美国专利+美国商业化:受二战影响,英国没有条件继续资助青霉素的研发工作。1941年7月,弗洛里团队在美国洛克菲勒基金会的资助下,到美国进行青霉素的开发工作。美国政府意识到青霉素的重要性,不仅提供市场、研究资金,还协调各部门的工作,调动了30多个实验室、1000多位科学家,以及20多家制药和化学公司来完成青霉素的产业化。由此,青霉素的开发权和生产技术的知识产权逐渐被美国控制。
美国政府为满足军方需求而开展的一场青霉素的产业化运动,为美国医药企业快速跨越式发展提供了绝佳路径。由此,美国企业获得了可观盈利,积累了投资创新的资金,锻炼了人才,夯实了产业基础。而英国因二战及“重学术轻专利”的学术文化的影响,陷入“诺奖归我,专利归他”的境地。英国的“种子”在美国结果,英国连基本的专利授权费也没有正真获得,更不用说丰厚的产业化收入。
中国研究:1967年5月,当时的国家科技委员会与原总后勤部组织召开会议,号召遍布全国的多家研究单位,仿造西药或制造衍生物、从中药中寻找抗疟药、制造驱蚊剂。屠呦呦研究小组通过查阅古方寻找可能的抗疟新药,从多种可能的动物药、矿物药和植物药中进行筛选,最后锁定了青蒿,但遇到了提取有效成分的难题。屠呦呦提出用提取青蒿,其提取物抗疟作用达95%—100%,这一方法是当时发现青蒿粗提物有效性的关键。屠呦呦研究小组于1972年3月报告了这一结果。1977年,青蒿素的化学结构以“青蒿素结构研究协作小组”之名在《科学通报》上首次发表;1982年发表了英文论文。
中国错失专利:20世纪70年代,中国还没有建立专利制度。因此,虽于1972年提取出了青蒿素单体,但并未实施专利保护。同时,在青蒿素研发接近成果期时,中国研究人员在国内外发表了一系列文章;而专利授权的基本前提是“新的”,论文公开之后,如果超过6个月还没申请专利,专利就会因为公开在先无法授权。因此,中国错失了青蒿素类衍生物在国际上申请专利的最好时机。此后,中国开始研究起草专利法,1985年4月1日《中华人民共和国专利法》正式实施。军事医学科学院研发的复方蒿甲醚成为中国第一个严格按照国际标准开发、拥有自主知识产权的青蒿素类复方药物。
欧美夺取专利:公开发表的文章导致技术细节暴露,国外在青蒿的引种栽培、育种和种植试验、药理研究,以及衍生物的研究均已全面启动。美国军方在美国本土也寻找到青蒿并提取出青蒿素,肯定青蒿素功效的文章于1985年在《科学》(Science)上发表。国外企业在青蒿素上逐渐构筑了厚实的专利“护城河”。
欧美商业化:疟疾是全球性疾病,青蒿素进入国际市场需要符合一些规则和规范等监督管理要求。而中国改革开放初期,科学家及科研管理人员对药品注册、专利申请、临床试验和药品生产的国际规范还比较陌生,军事医学科学院最后选择与瑞士诺华公司合作。1991—2018年近30年的协议期中,中方获得复方蒿甲醚的专利费收入接近2000万美元。对于该项合作,诺华公司有着完整的专利战略思路:先围绕青蒿素衍生技术申请自有专利,再通过合作中的一些契机从中方手中购得某些关键专利,逐步从一个专利的被许可者变成专利壁垒的持有者,而中国药企则沦为原料药供应商。
由于中国的知识产权、监管政策、产业短板,同样陷入“诺奖归我,专利归他”的境地,中国没能像美国利用“青霉素”的产业化实现产业跃升。
英国研究:1975年1月,英国研究员塞萨尔·米尔斯坦(César Milstein)和德国研究员乔治·科勒(George Köhler)在英国医学研究委员会,研发出生产单克隆抗体的技术——杂交瘤技术。
英国错失专利:负责为英国医学研究委员会申请专利的国家研究与发展公司(NRDC)认为,虽然杂交瘤技术可能具有医疗和商业经济价值,但无法确定“任何立即的应用”,因此没有迅速采取申请专利的行动。1976年8月,相关论文发表在《自然》(Nature)后,就错失了在英国获得该技术专利的机会——英国《专利法》规定,一旦论文公开发表就无法再申请专利保护。
美国专利:1979年10月和1980年4月,美国威斯塔研究所(Wistar)的希拉里·科普罗斯基(Hilary Koprowski)、卡洛·克罗斯(Carlo Croce)和沃尔特·格哈德(Walter Gerhard)接连获得2项制造抗肿瘤和抗流感病毒的单克隆抗体的专利,开创了为制造单克隆抗体授予专利的先河。而这3位美国科学家使用的关键材料X63骨髓瘤细胞系,是由英国科学家米尔斯坦于1976年9月提供的。由于英国主要关注科学方面,没有特别考虑商业应用;而且,当时由英国政府资助的科学家无权获得专利特许权使用费。这进一步加剧了“重学术轻专利”的情况,导致英国错失专利,反而间接帮助美国人拿到相关专利,这在英国引发了重大政治争议。后来,英国对专利申请制度进行了重大改革。
现在来看,米尔斯坦和科勒的单克隆抗体是从小鼠细胞中开发出来的,而这种单克隆抗体直接用于人体会产生免疫排斥反应。因此,即便美国科学家申请到专利,最后也无法成功商业化应用;但是,这种申请专利保护的意识和文化是“万里长征第一步”,十分重要。
英国研究:1986年,同样在英国医学研究委员会工作的格雷格·温特(Greg Winter)开发出通过蛋白质工程实现单克隆抗体“人源化”的方法。
英国专利:英国医学研究委员会这次迅速提交了该技术的专利申请,随后多年在全世界内颁发了40多项非独家许可。自那时起,英国医学研究委员会从该项专利技术中获得了近6亿英镑的特许权使用费收入。
英国、德国初期商业化:1989年,温特成立了剑桥抗体技术公司(Cambridge Antibody Technology),其是早期涉足抗体工程的商业生物技术公司之一。1993年,剑桥抗体技术公司和德国巴斯夫公司(BASF)合作。通过平台技术筛选,筛选到针对肿瘤坏死因子(TNF)抗原的人源化单克隆抗体,将其命名为D2E7。巴斯夫公司旗下医药公司Koll药业,负责D2E7的临床前和临床研发工作。但Koll不擅长全球的创新药学术推广,而未来的开发与销售还需投入更多且不确定性大,特别需要强有力的合作伙伴,因此将其出售。
美国最终成功商业化:美国雅培药业用69亿美元收购了Koll药业,重点投入D2E7临床后期的开发,最终开发出单克隆抗体药——阿达木单抗(商品名:修美乐/Humira)。2002年获得美国食品药品监督管理局(FDA)批准用于类风湿关节炎患者;随后几年,修美乐获批17种适应证,并在全球几十个国家销售,到2023年初已经获得2128亿美元的出售的收益。美国雅培药业凭借69亿美元的收购,加上后续临床研发、适应证拓展、市场营销、生产基地及物流的投入,换来超过2000亿美元的回报。
英国吸取之前错失专利的教训,及时申请到了专利,随后也进行了商业化的尝试。最后成功的商业化在美国实现。英国获得了一定的专利授权费用,但没有收获商业化的丰厚利润。
日本研究:20世纪90年代,日本是世界免疫学的研究重镇,京都大学本庶佑课题组发现了PD-1单抗治疗癌症的可能性及相关机制,并于2002年在动物实验中获得了证实。
日本专利:2002年,本庶佑希望将此项研究转化为治疗患者的新药,但是京都大学不具备任何管理能力或申请专利的知识,甚至没有钱支付专利申请费用,无法为他提供帮助。他只能利用自己在业界的人脉,与日本小野制药公司合作,申请到PD-1免疫疗法的临时专利。
美国商业化:日本公司对此疗法表示怀疑,因为当时利用免疫疗法治疗癌症的临床试验,都以失败告终。本庶佑只能将希望转向海外。总部在美国普林斯顿的Medarex公司拥有业内先进的全人源抗体开发平台,正在寻找富有潜力的研发项目;于2005年和小野制药公司达成合作,共同推进这款免疫疗法的临床开发。2009年,百时美施贵宝(BMS)公司收购梅达雷克斯,将此疗法命名为BMS-936558(后被称为纳武单抗/nivolumab),这使得研发过程得到质的飞跃。2014年7月,该款新药在日本率先获批上市,纳武单抗(商品名:欧狄沃/Opdivo)成为全世界首个获得监督管理的机构批准的PD-1抑制剂。Medarex和小野制药已于2006年申请了《专利合作条约》(PCT)专利,后因并购协议,专利所有权为百时美施贵宝所持有。2017年,小野制药和百时美施贵宝起诉默沙东公司侵犯专利,默沙东公司同意赔付6.25亿美元的专利使用费,以及派姆单抗(Pembrolizumab)(商品名:可瑞达/Keytruda)2017—2022年出售的收益的6.5%,以及2023—2026年出售的收益的2.5%。
从该案例能够准确的看出,由于日本缺乏完善的专利转化环境和商业化环境,日本基础研究的成果也需要在美国才能转化成临床所需的药品。日本得益于专利保护,能够得到专利授权和专利侵权的赔付收入,但却没有办法获得商业化全部收入。
美国研究+美国专利:20世纪90年代和21世纪初,美国宾夕法尼亚大学(以下简称“宾大”)的生物化学家卡塔林·卡里科(Katalin Karikó)和免疫学家德鲁·魏斯曼(Drew Weissman)致力于把使用mRNA变成一项可行的技术,进行了艰苦的研究。当时,一些研究人员已能将mRNA有效地传递到体内,但无法使其在人体中安全地发挥作用。一开始的研究不太顺利,1995年,卡里科在宾大被降职,资助也屡遭拒绝,甚至不得不在黑市上卖掉她的汽车来维持生计。转折点出现在21世纪初,他们发现,将mRNA的尿苷(U)替换为假尿苷(ψ)可以顺利逃逸细胞的免疫监测,达到在人体安全发挥作用的要求。这是开发mRNA疫苗的关键技术之一。两人于2005年发表了文章并申请了相关专利。
美国商业化:2006年,卡里科和魏斯曼创立了RNARx公司,并于2007年和2009年得到美国国立卫生研究院(NIH)的小企业技术转让计划(STTR)的2笔共计近90万美元的资助。宾大于2010年将专利独家授予了美国一家实验试剂供应公司Cellscript,获得30万美元专利授权费。后来,美国莫德纳公司(Moderna)和德国拜恩泰科公司(BioNTech)开发的新冠mRNA疫苗都需要这项关键技术,因此向Cellscript支付了数亿美元的转授许可费。德国拜恩泰科公司和美国辉瑞共同开展研发活动,在拜恩泰科公司完成首次人体临床研究后,辉瑞公司全权负责基于mRNA的新冠疫苗的进一步临床开发和商业化。莫德纳公司和拜恩泰科公司作为最先推出新冠mRNA疫苗的公司,仅2021年,这2个公司生产的新冠mRNA疫苗全球销量就达到500亿美元。
此案例可以反映出美国生物医药创新系统从基础研究到商业化转化的概貌,涉及基础研究、应用转化、专利转化、商业化等全过程。大学主动帮助申请专利,并能够从中获利;产业链上的企业也热衷于向大学购买专利。作为一种投资品,专利价值在不断交易中逐渐显现,得到相应的资金回报。美国生物医药生态系统较为完善,各环节都设置了机制政策和激发鼓励措施,从而使得创新的果实能不断接力成熟,这是生态系统的灵魂。
全球基础研究:1987—2011年,经过25年探索,由多国多名科学家共同完成CRISPR/Cas9系统基础理论研究。在CRISPR/Cas9基因编辑技术相关的基础理论研究方面,作出贡献的基本没有美国人(图1)。第一个发现CRISPR序列的是日本科学家;之后,对探索和发现CRISPR/Cas9机理作出主要贡献的大都是欧洲科学家。
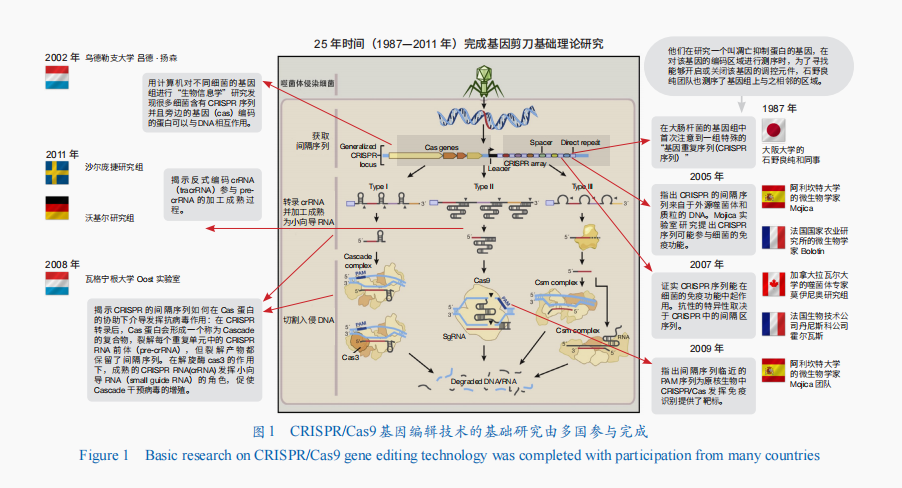
美国专利:2012年,来自瑞典于默奥大学的法国科学家埃玛纽埃勒·沙尔庞捷(Emmanuelle Charpentier)和美国加利福尼亚大学伯克利分校的珍妮弗·杜德纳(Jennifer A Doudna)共同揭示了Cas9蛋白的工作机理,随后才意识到CRISPR/Cas9可当作基因剪刀来使用,发表了文章并申请了相关专利。2013年,哈佛大学的乔治·丘奇(George Church)、麻省理工学院的张锋和加利福尼亚大学齐磊(Lei S. Qi)实验室,首次将CRISPR/Cas系统成功应用到哺乳动物细胞中,申请了相关专利。
美国商业化:美国福泰制药(Vertex Pharmaceuticals)和瑞士美国合资公司CRISPR Therapeutics联合开发了利用CRISPR/Cas9基因编辑技术的基因疗法Casgevy,分别于2023年12月和2024年1月经FDA批准用来医治镰状细胞病、输血依赖性β地中海贫血症(定价220万美元)。Casgevy是FDA批准的第一个利用CRISPR/Cas9基因编辑技术的疗法。
美国科学家拥有敏锐地将科学转化为产品的意识和能力,辅以美国强大的生物医药创新生态,助力美国可以将全球的基础研究投入转化为本国的商业利益。假如没有这种意识和能力,以及完善的生态,再多的基础研究投入也只是为他人作嫁衣,这在欧洲(如青霉素、单克隆抗体)、日本(如PD-1单抗)和中国(如青蒿素)都有一定的教训。
英国(如青霉素、单克隆抗体)和日本(如PD-1单抗)的实践表明,科学论文或知识产权对社会的影响是有限的,关键是如何将想法转化并运用到实践中,产生经济社会效益。文化是最根本、最持久,也是最难模仿的竞争力,建立创新文化很重要,也极为艰难;但是,只有将创新制度、创新政策和创新文化有机结合起来,劲往一处使,才能真正打造出有效激励颠覆性创新产生、成长的土壤、环境和生态系统。
欧洲的政策解决方案往往侧重于向基础研究注入更多资金,以填补与美国的差距。资助基础研究对于现代工业经济至关重要,但除非欧洲的政策制定者也能解决其文化和政治体系中面临的激励问题,否则增加的投入不一定会产生预期的收益。前述案例中,青霉素、单克隆抗体的基础研究都是由英国科学家完成的,但最后药品开发和商业化都落在美国,这并非偶然事件。
将视野放大来看,据估算,2015—2021年,全球新生物技术公司中,欧洲仅占25%,只有1/3的新药批准来自欧洲生物医药生态系统。原因主要在于:欧洲资本、知识、人才密集度与美国相比还较低。企业家、技术人才和投资者的大量聚集于硅谷和纽约,对美国初创企业的成功产生了重大影响;美国一半以上的初创企业是从这2个城市崛起的。尽管伦敦、巴黎、柏林和斯德哥尔摩在欧洲处于领头羊,但在资本、知识和人才集中度方面尚未达到同等水平;只有30%的欧洲初创公司将总部设在上述城市。对基础研究和商业转化的资助不平衡。欧洲对大学的纯基础研究有充足的支持,但对向商业化的过渡缺乏足够的资金支持。缺乏创新创业的文化传统。从思想认识和学术文化上,英国科学家更关注科学方面,而不是商业应用。里德·霍夫曼就一语道破,“硅谷不是一个地点,而是一种心态”。麦肯锡的一份研究报告分析了一些国家的媒体对创业的态度,德国对创业精神的积极描述比例仅为17%,而美国为39%。除了缺乏创业心态,还缺乏创业知识,敢于创业的人也就比较少,德国只有5%的人有创办公司的计划。
前述案例中,在21世纪初的日本,大学因缺乏申请专利的动力和能力,诺奖级成就只能依托发明人个人与产业界的联系,专利才得以申请。专利申请没有可靠的制度支撑,而是依靠偶然性获得。此外,日本科学家即使申请到了专利,但是其国内的生物医药公司眼光和实力并不足以孵化颠覆性的技术产品,专利最终也难以在本国商业化。
将视野放大来看,尽管日本在基础研究质量方面名列前茅,政府也有政策,但将学术知识转化为商业或社会收益的系统存在缺陷。美国麻省理工学院的一篇论文指出,日本与美国相比,产业高质量发展的利益相关者结构基本相同,但在活性、数量和质量上存在一些差异。 研发投入强度较高但规模仍偏小。2000—2019年,日本的研发强度连续20年高于美国,但与美国相比规模仍然比较小。生物医药创新具有高投入的特征,投入量级至关重要。人才流动性低,知识、技术等信息在利益相关者之间共享困难。日本的薪资是按照终身雇佣资历排名的,日本大学和工业界研究人员的流动性低,每个利益相关者的知识仅在自己的组织中积累,而不是在利益相关者之间共享。风险资本规模小且专业性不足。以2017年为例,风险资本总额,日本仅为美国的2%;风险投资占GDP的比重,美国为0.4%,日本为0.03%。美国每笔交易的风险资本在种子阶段为170万美元(日本为50万美元),在早期阶段(A轮融资阶段)为1100万美元(日本为80万美元),在后期阶段为2880万美元(日本为100万美元)。此外,生物医药领域的高风险性对风险投资家的专业性要求也高,美国风险投资家很多都拥有医学博士(MD)和/或博士(Ph.D.)学位。而日本投资方明显缺乏专业性,导致对创业者/初创企业的支持不足,这从前述PD-1案例可见一斑。 技术转让面临挑战。ECO的核心价值是大学、初创企业和制药公司之间的技术交换。从专利数量来看,东京大学和京都大学的国际专利数量超越了美国的哈佛大学和斯坦福大学。然而,日本大学的专利总收入相当低。哈佛大学和斯坦福大学的年收入从始至终保持在4000万美元以上,而日本的大学从未超过1000万美元。美国大型药企强调开放式创新,大型药企和初创生物技术公司与大学之间形成良好的合作生态;而日本大型药企往往只注重内部研发,这极大地降低了日本生物医药产业的创新能效。⑤ 公司数和活力均不足。日本生物医药产业集群中的公司数远少于美国,日本的创业态度低迷。大学的学生能接触到创业者的机会非常有限。由于缺乏企业家榜样,学生害怕成为企业家,导致日本的企业家人数较少。 支持性服务组织不成熟。企业家数量较少,意味着对企业家的支持和/或服务的需求较低。同时,日本企业家或初创公司的小团队通常不具备建立公司所需的所有技能和知识,这形成了恶性循环。在美国,有许多支持性组织可以为初创企业特别是“加速器”“孵化器”提供服务,包括专对于生物技术初创企业的项目;同时,美国还有在生物技术方面拥有丰富专业相关知识的律师事务所和顾问。日本尝试移植这些系统,但才起步,这些活动的可用性还不够。日本还面临政策一致性的问题。面对人口老龄化的挑战,日本进行了严格的药品价格管制,1981—1991年的11年间,日本的药品价格下降了67.9%。在整个专利保护期内,无论创新价值如何,日本的药品价格都会定期统一调整。这导致了日本公司推出一系列产品寿命短、创新价值低的新药,而不是投资于更实质性的创新。日本政府认识到其制药行业步履蹒跚,在2010年推出了一项名为“价格维持溢价”(PMP)制度的试点计划,旨在为创新者创造一个稳定可靠的定价环境。PMP于2012年、2014年和2016年更新。减少药物审批滞后,确保日本创新产品得到了适当的估值,促进了创新。但是,2017年12月,日本厚生劳动省又实施了改革,大幅度的增加获得PMP资格的难度;还于2018年降低了几种主要创新药物的价格,并且这些药物需要接受持续的卫生技术评估(HTA)成本效益试点计划,以此来降低了上市时授予的价格溢价。日本政府反复横跳,既想拥有一个创新的具有竞争力的生物医药产业,但又继续人为压低药价,两者始终难以兼顾,阻碍了其生物医药产业的发展。
疾病是人类共有的,生物医药产业是全球化的,基础研究是全球投入和全球的科学家一起努力的成果。美国拥有成熟的创新生态,除了自身的科研成果可以转化为产出,其他几个国家的科研成果也可以在美国转化。美国成熟的创新生态能将风险极大的事情,通过种种机制传导,分散投资风险,让创新的火种不断传递——过程中要么不断进化成熟,要么快速退出。上述案例中,虽然日本、英国在基础研究上取得了突破,并因专利保护获得了专利授权收入,但是商业化还是在美国才得以完成。以“药王”修美乐为例,英国公司获得了69亿美元的收购费用,美国雅培公司则继续投入后续临床研发、适应证拓展、市场营销、生产基地及物流,最终换来超过2000亿美元的回报。日本的科学家及医药企业没办法完成PD-1商业化,最后由美国百时美施贵宝公司接棒;药品还未上市,该公司股票价格便上涨约130%(2013—2015年),从而支撑企业的进一步创新。CRISPR/Cas9基因编辑技术的基础研究涉及多国科学家的贡献,包括日本、加拿大、法国、瑞士等,但是最后关键性的技术发明和商业化主要是在美国完成。这些案例表明,若只重视基础研究投入而忽视创新生态,容易陷入为他人作嫁衣的境地。
综上,生物医药产业的竞争不仅是基础研究的竞争,更多是整个创新生态体系后的体制机制的竞争。美国在生物医药领域处于全球领头羊,得益于其完善的创新体系,包括庞大的支持购买创新的国内市场、政府不限制药品价格、知识产权保护、支持性的科学政策和支持性的创新集群等。这些反过来又鼓励了大量的私人研发投资,形成了风险投资所需的充满活力的生物医药创业ECO,以及生物医药学术界、政府和工业界之间的协作环境。
要把提高基础研究投入与持续完善生物医药创新生态作为促进我国生物医药产业高水平发展的两大方向,后者可能更为紧迫。
虽然通过欧洲和日本的实践看出,基础研究并不是万能神药,但是仍然应该清醒地意识到,基础研究薄弱是我国生物医药领域的重大短板。我国必须贡献大量“0到1”的成果,以得到世界科学界的尊重认可。以2021年为例,我国政府在所有自然科学领域基础研究的投入为1679亿元人民币,仅相当于美国NIH在2022年对生物医学领域基础研究的投入。我国在生命科学领域基础研究的投入还需大力增加,才能奠定科学基础。由于我国自身根源上缺乏基础上的创新,大多创新药科学家为留学海外并曾在跨国药企工作多年的人员,导致过多同靶点的仿首创新(Fast Follow),致使外国同行误解,认为中国学者有剽窃专利之嫌,影响中国创新的声誉,面临诸多风险。
我国高校院所对生物医药基础研究的贡献还非常不足。如前述,我国初创生物技术公司很多是留学归国人员,本土大学对科学、技术、人才的供给还非常不足,尚未形成气候。这是我国生物医药产业创新生态的重要缺陷,应做出相关改革。设置类似美国NIH这样,专门、专业化资助生物医学研究的渠道和机制,在统一的资助渠道下,内设对初创企业资金支持的机制,推动研究成果转化。目前,我国对生物医学研发的资助分散在不同部委,缺乏统一规划和资助机制。科研经费由政府部门一手操办,而不是由独立的学术机构承办;由于生物医学学科广泛,通常只有数名项目人员组织项目立项、评审,不尽合理,既难以适应科学技术创新规律又增加决策风险。提高生物学相关课程质量。伴随知识的飞速扩张,现在的教学体系中,教师经常注重深入讲解某一小领域的最新知识,但这种碎片化的知识,缺少整体性,不容易看到不同现象后的共同本质,不容易在新的问题面前运用已经学过的知识。对于培养具有宽阔视野和深入洞察力的思想家和科学家是远远不足的。建议选择一些高质量的教材开设高质量的科学史课程,还原科学知识产生的真实过程,其中饱含曲折艰难。这一方面能激励科学研究人员,另一方面能摒除迷信科学的思想和做法;科学的灵魂从不是崇拜而是批判,用科学精神来指导研究工作,提升创造能力和融合能力。例如,饶毅开发的《生物学概念与途径》课程可通过远程教育的方式广泛传播。普遍增加生物医学领域MBA等创新创业教育课程的供给,增加在校学生接触创业者的机会,畅通企业家和大学教师之间的职业交流通道。通过接触企业家榜样,激发学生的创新创业激情。即便不去创业,学生也能了解企业、市场的需求。畅通医疗机构和生物技术公司的常态化交流合作通道。发挥我国丰富的临床研究问题导向优势,形成临床需求和产品研发的良性循环,避免企业研发立项主要是依靠“看市场上哪个药卖得好”而导致的盲目跟风式恶性循环。畅通高校院所、医院等财政支持项目的科技成果转化通道,完全解决“不敢转”的难题。我国大多数科研人员都在国有的高校院所、医院工作。要妥善处理职务发明成果转化收益奖励与国有资产管理的关系,充分调动体制内科研人员发明创造的积极性,推动科学技术创新带动产业创新。逐步的提升我们国家医药监管的水平,完善药品知识产权保护体系。药品监管和知识产权保护是支持生物医药产业创新发展的重要基石制度,需要格外的重视,花费更大力气去完善。
购买端是生物医药产业创新生态的重要部分,要充分激活我国超大规模市场购买创新的潜力
美国的生命科学创新部门由大型成熟药企和小型初创生物技术公司组成,大型成熟药企创造了“对新技术的需求”,从而能够激励小型初创生物技术公司的发展。美国小型初创生物技术公司的成立受到NIH的“小企业创新研究计划”(STTR)、“小企业技术转移计划”(SBIR),以及大量风险资本的支持而创办,退出渠道通常是大型药企的并购或者首次公开募股(IPO)上市。进一步的研究发现,23%的生命健康类初创企业的退出通过IPO,48%通过并购退出的,29%退出失败。其中,通过并购退出的可能最终也是失败的,这个风险由收购方承担。一般较为成熟的融资市场,IPO收紧会导致并购市场的火热,一些生物技术企业能选择被并购的方式进行退出。美国生物技术公司从20世纪80年代开始发展,但从生物技术公司成功晋级大型药企的仅5家,分别是安进、吉利德、渤健、再生元、福泰制药——全部依靠超级大单品实现“蝶变”。从成立到首款产品获批上市平均10年以上,实现稳定盈利甚至需要20年以上,在此期间需要源源不断的资本活水来维持高额的研发投入。据“阿基米德Biotech”研究,我国2家出海最成功的创新药企——百济神州和和黄医药商业化收益全靠海外支撑;由于受到价格谈判影响,国内市场收入有停止爬坡的迹象,这与生命周期早期成长阶段不匹配。
我国至今尚无国际化的大型药企,传统药企大都是原料药企、仿制药企,利润较低。因此,我国生物技术初创公司缺乏像美国那样既有资金实力又具有专业眼光的购买方(大型药企),几乎只能依赖IPO;一旦IPO中断,那么整个产业的发展便失去了激励。同时初创公司的风险是极大的,太高的风险也是股市、股民难以承受的。当前,我国一些初创公司海外授权一些优质管线仅是权宜之计。长远来看,必须发展我国的具有国际竞争能力的大型药企,为我国初创生物技术公司成功晋级大型药企提供优渥环境很重要。若不积极改善,我国的“种子”只能在国外开花结果,或者在国内销声匿迹。
我国初创生物技术公司当前面临的主体问题是融资难、定价低和进医院销售难。2024年风险投资投向创新药的资金比2021年下降70%,绝大部分企业融不到资金;企业“卖青苗”给跨国公司,也是“融资难”大背景下的现实选择。融资难的原因是定价太低。医保灵魂砍价结果是,中国创新药价格平均比全球最低价低39%,比美国低90%,比欧洲和日本低50%—70%。全国三级医院1.2万家、三甲医院3300家,只有5%—10%的医院采购创新药达到上市数量的平均数。应下定决心迅速改变这种不利状况。要格外的重视购买端对生物医药产业的及其重要的作用。只有这样才可以为我国培育出世界级的医药巨头,丰富初创生物技术公司的退出渠道,形成可持续的生物医药创新系统,增强我国生物医药产业的全球竞争力。